近日,南华大学公共卫生学院孙小雅博士以共同第一作者(第一署名)在Cell集团旗下国际期刊《Molecular Therapy》(《分子治疗》,IF:12.91)在线发表研究论文“Targeting PARP1 modulates METTL3 promoter chromatin accessibility and associated LPAR5 RNA m6A methylation to enhance cancer cell radiosensitivity”(中文名:PARP1调控甲基转移酶METTL3的染色质可及性,以调节其转录和随后的RNA的m6A甲基化,以调节放射敏感性),军事医学研究院辐射医学研究所周平坤研究员(孙小雅博士的导师)为主要通讯作者,南华大学公共卫生学院为第一单位。
多聚ADP核糖基转移酶PARP1是一个重要的DNA损伤修复调节分子,可催化多种功能蛋白ADP-核糖化修饰,改变蛋白质的活性、相互作用、定位和稳定性等,对细胞多个生物学过程产生重大影响。PARP1抑制剂作为临床肿瘤靶向治疗药物,以其合成致死 (synthetic lethality) 机制,对BRCA1或BRCA2基因突变等同源重组修复功能缺陷肿瘤显示出突出的疗效。为此,以PARP为靶向抑制剂的研发已经成为抗癌领域的一大热点。深入研究揭示PARP1的生物学功能机制,对于进一步扩展PARP抑制剂的临床肿瘤治疗应用范围和规避毒副作用具有重要意义。 RNA的m6A修饰是控制真核生物基因表达的一个关键调控环节,在细胞分化、分裂、DNA修复和命运、肿瘤发展和治疗意义等多种生物过程中发挥作用。

该研究发现人宫颈癌上皮细胞(HeLa细胞)和人肺癌上皮细胞(A549 细胞)经4Gy γ射线照射后早期反应中,细胞总RNA的整体m6A修饰水平被显著抑制。并分析发现METTL3介导了电离辐射所致m6A修饰总体水平的降低,电离辐射抑制METTL3基因的转录活性。进一步研究揭示,PARP1可结合到METTL3基因启动区,促使其染色质开放和转录激活,介导其靶RNA分子的m6A修饰。细胞受到照射或PARP1抑制剂处理后,PARP1从METTL3启动子区解离,导致后者染色质压缩,转录因子如NFIC和TBP与METTLE启动子的可及性降低,从而抑制METTL3表达。研究发现,在此调节信号通路中,溶血磷脂酸受体5(LPAR5)为METTL3的靶分子,其m6A修饰发生在3’UTR的A1881位点。在电离辐射或PARP1抑制剂作用后,LPAR5的m6A甲基化水平随着细胞中的METTL3表达抑制而显著降低,并且证实LPAR5 A1881位点的m6A甲基化水平下降可降低其RNA的稳定性。随后证实,与配对的瘤旁宫颈组织相比,宫颈癌组织中PARP1、METTL3和LPAR5的表达水平显著升高,并且LAPR5的表达水平与METTL3显著相关。METTL3靶向抑制剂可显著抑制裸鼠异种移植瘤生长,并与放疗表现出协同作用。该研究揭示了PARP1调节染色质重塑和m6A修饰调控的新机制,这为开发和精确应用PARP1抑制剂于癌症治疗以及提高癌症放疗的有效性提供了有利实验理论支撑。
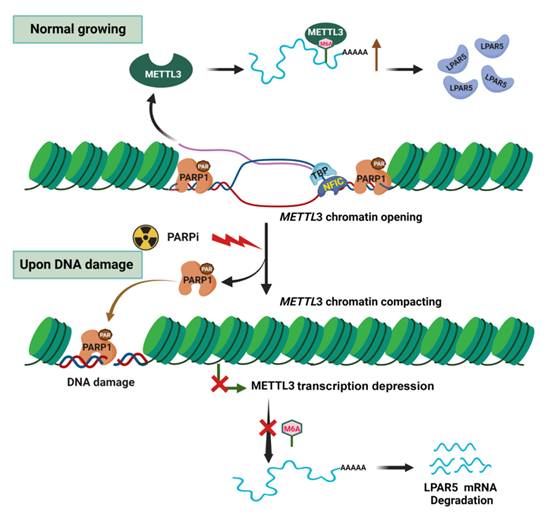
PARP1调控METTL3的染色质开放性,以调节其转录和下游的RNA的m6A甲基化的关键机制图
此前,孙小雅博士还以第一作者身份在《Journal of Translational Medicine》(转化医学杂志,IF: 8.44)发表论文“LPAR5 confers radioresistance to cancer cells associated with EMT activation via the ERK/Snail pathway”(中文名:LPAR5通过ERK/Snail途径促进EMT转化,增加放射抵抗性,https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9533496),揭示了LPAR5促进细胞EMT转化和癌细胞迁移,γ射线照射可显著增加LPAR5的表达,增加癌细胞对放射的抵抗性。靶向抑制LPAR5可阻断ERK信号通路的激活及下游靶分子Snail、MMP1和MMP9的表达,抑制电离辐射诱导EMT的作用,达到肿瘤的放射增敏的目的。


